Science背靠背(二)丨叉枝蝇子草性染色体演化
开花植物的性染色体最早发现于叉枝蝇子草(Silene latifolia,核型2n=22A+XY)。其“巨型"Y染色体(约500Mb)已成为研究具有大型MSY的异形性染色体的经典模型。近日,国际顶级期刊《Science》背靠背发表了两篇叉枝蝇子草Y染色体的研究论文,上一期我们已经介绍了其中一篇,今天我们详细给大家介绍另外一篇“Rapid and dynamic evolution of a giant Y chromosome in Silene latifolia”的研究内容。

一、蝇子草属物种基因组序列分析
叉枝蝇子草(S. latifolia)及其近缘雌雄异株物种S. dioica共享相同的性染色体,这些性染色体是在与雌雄同体物种S. vulgaris分化后演化形成的。
作者结合PacBio HiFi测序、Bionano光学图谱和Hi-C互作图谱、分子标记细胞遗传学锚定及遗传图谱,成功组装了S. latifolia雄株、S. dioica(雌雄异株)雄株及S. vulgaris(雌雄同株)两性株的染色体级别基因组,BUSCO评估等都显示组装基因组的高质量。
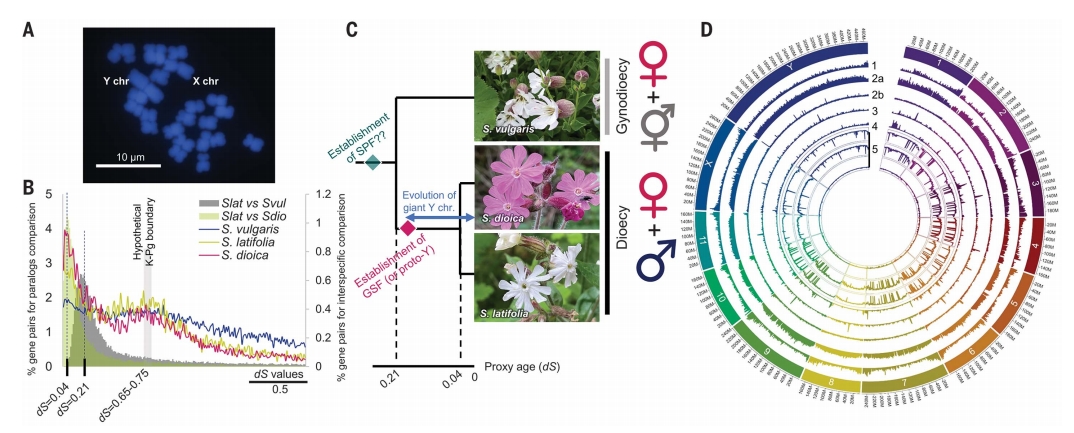
图1:叉枝蝇子草及相关物种(S. dioica 和 S. vulgaris)性染色体与基因组特征概述
二、叉枝蝇子草Y染色体结构特征
通过雄株减数分裂遗传标记定位,作者发现Y染色体包含一个大型非重组雄性特异区(MSY)和一个位于末端的拟常染色体区(PAR)。作者利用FISH对MSY区域进行细胞遗传学分析发现,不同地理种群的Y染色体结构存在差异:本研究所用材料的Y染色体排列方式与K系不同。
CENH3 ChIP-seq实验表明,Y染色体着丝粒区未形成成熟的着丝粒重复序列,支持其因重排导致着丝粒相对位置改变的观点。与此一致,H3K9me2和DNA甲基化在MSY区广泛分布。另外Gypsy类及未知类LTR在MSY及常染色体着丝粒周缘低重组区显著富集。
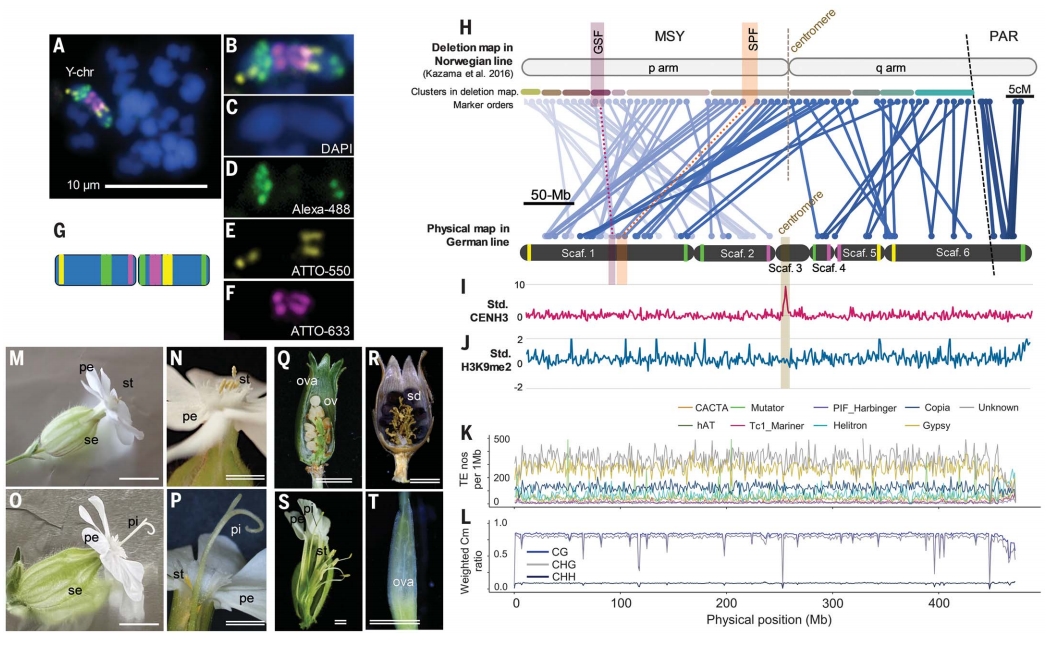
图2:叉枝蝇子草Y染色体的基因组学特征
三、叉枝蝇子草属X与Y染色体的分化
早期花原基表达分析支持先前的GSF候选基因SlCLV3,其X与Y拷贝高度分化,且在雄花芽原基中仅检测到Y-SlCLV3表达。通过ALSV诱导的VIGS实验,作者在S. latifolia雄株中抑制Y-SlCLV3表达后,成功诱导出功能性两性花。SPF区域内的重要候选基因是TWD1的直系同源基因,该基因在S. latifolia和S. dioica中为Y染色体特异,并在雄花原基中高表达。
S. latifolia和S. dioica的MSY与其X染色体同源区极少。一个高度重复区域在两物种间保守。McDonald-Kreitman检验显示少数S. latifolia重复基因可能受正选择,但多数呈近中性或受负选择,符合重复基因纯化选择减弱的理论预期。
S. latifolia雌性减数分裂中,X染色体大部分区域重组频率亦较低。包括S. vulgaris在内,所有染色体中段存在广泛的重组抑制区,这些区域的LTR反转座子(LTR-TEs)和DNA甲基化密度接近MSY水平。
基于Y染色体组装,作者首次将退化程度与stratum关联。在stratum 0区域(对应X染色体左侧重组区与中央低重组区的交界),>70%的基因呈现X特异性,退化程度远超无Y组装时的预估。stratum 1退化较轻,该区域包含部分重组区及>200 Mb的着丝粒周边低重组区。靠近PAR的stratum 2退化最少,包含S. dioica中部分性连锁基因——这些基因在S. latifolia分化后停止重组,并显示轻微但显著的Y-X分化增强。
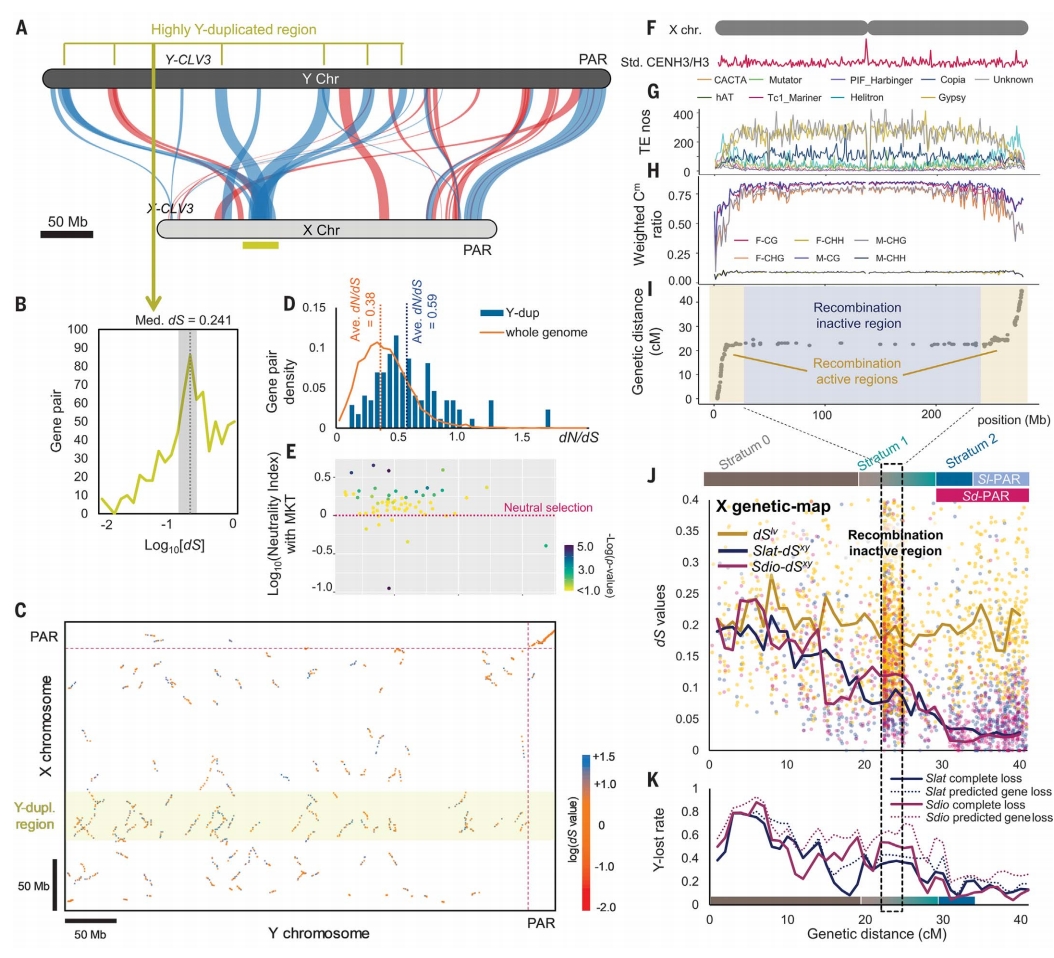
图3:叉枝蝇子草Y与X染色体的比较分析
四、性染色体中非重组区域的建立过程
与S. vulgaris的全基因组比对分析显示,S. latifolia和S. dioica的X染色体大部分对应于S. vulgaris的4号染色体,但部分区域与其他三条S. vulgaris染色体同源,表明在S. latifolia和S. dioica分化前可能与S. vulgaris染色体发生融合,或S. vulgaris谱系自身发生重排。
stratum 0和部分与X染色体着丝粒边缘区重叠的stratum 1对应于S. vulgaris 4号染色体的重组活跃区,证实S. latifolia和S. dioica的MSY是新近演化出的重组抑制区域。
根据上述双基因假说,两个初级性别决定基因应位于最早发生重组抑制的区域。GSF(Y-SlCLV3)确实位于stratum 0。但SPF候选基因由于Y特异性及重排,其X位置无法确定。作者在stratum 0左端发现一个潜在性别拮抗基因SlBAM1,可能影响S. latifolia的第二性征二态性。SlBAM1在S. latifolia和S. dioica的Y染色体上存在雄性特异性序列(Y-BAM1),且在雌雄同体的S. conica中也存在该基因。性别决定因子与SlBAM1紧密连锁的选择可能促进了stratum 0的演化。
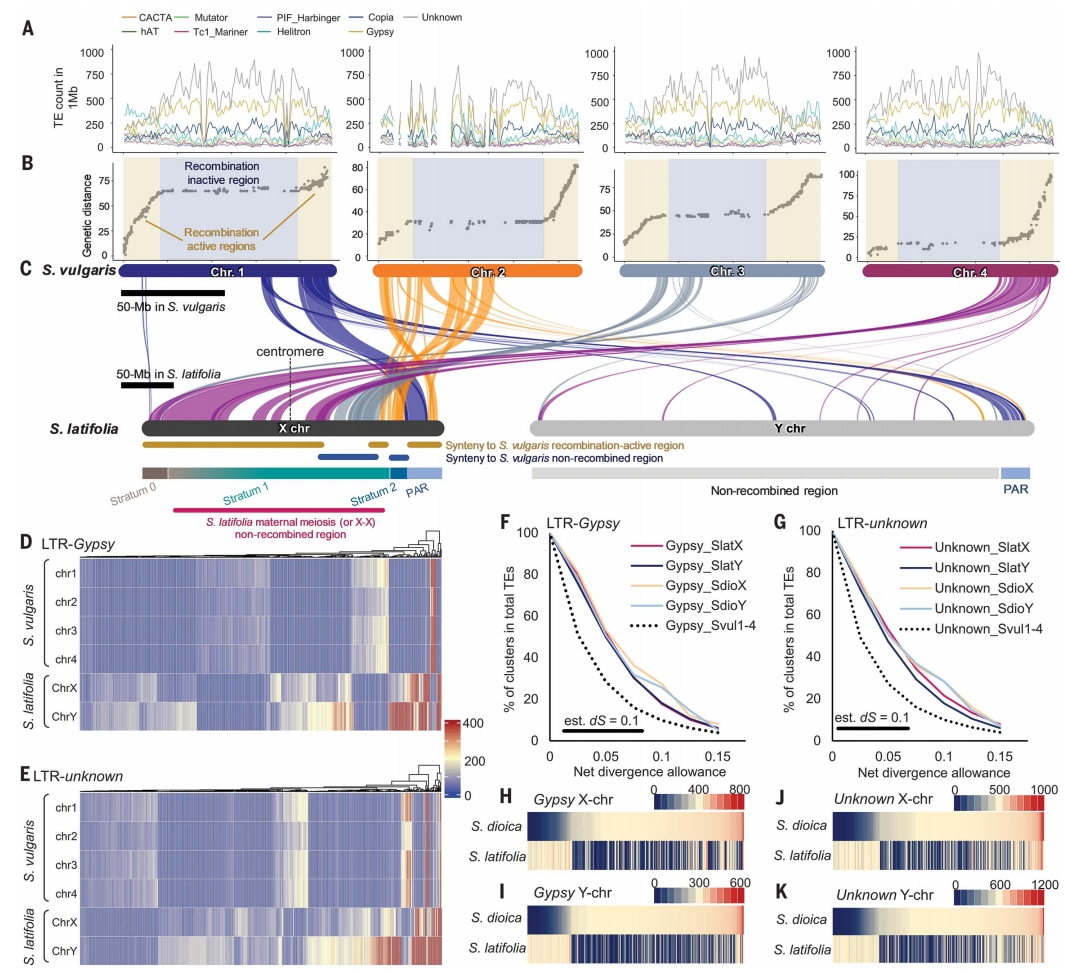
图4:S. latifolia与S. vulgaris的比较基因组分析
五、性染色体演化模型
最后作者总结了基于本研究结果的Silene Y/X染色体演化模型,支持X染色体原有重组区间的重组抑制。在"双突变"演化场景下,SPF突变(产生雌株)可能先于紧密连锁的GSF(SlCLV3)突变出现。促使了XY重组抑制,形成stratum 0。随后可能由于Y连锁SlBAM1基因受到进一步选择。TE插入和重排在MSY区积累,阻碍stratum 0内部及与着丝粒周缘区的重组,扩大Y连锁区域。融合或Y重复可能通过将交换推向PAR扩展低重组区,形成stratum 1。
X的结构重排少于Y,Y染色体仍在活跃重排,并持续退化。许多X连锁基因在雄株中已呈半合子状态,stratum 0/1开始出现剂量补偿,但Y退化和X等位基因上调无法解释最年轻的stratum 2。
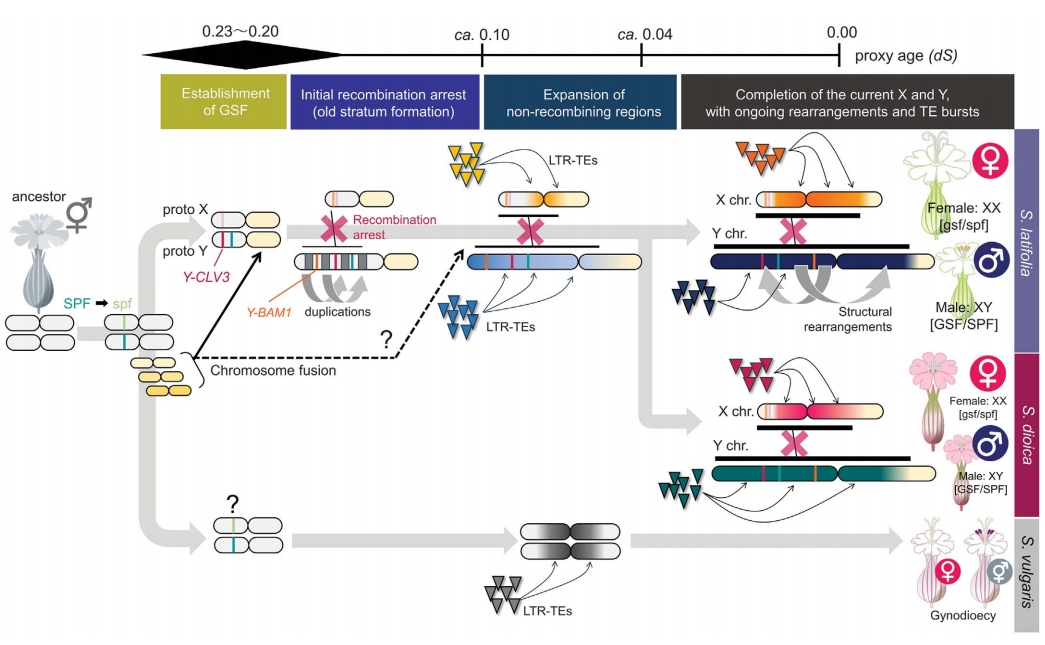
图5:S. latifolia与S. dioica性染色体快速动态演化模型
结语
染色体性别决定机制不仅广泛存在于动物界,亦见于多种植物物种中。现存大多数开花植物为雌雄同体,其性染色体的进化历史远短于许多动物,且在不同谱系中独立演化。因此,这些植物为研究"祖先雌雄同体如何演化出性别分化"过程中的性染色体形成机制提供了理想模型。
叉枝蝇子草于1923年首次被发现具有巨大的异形性染色体。其Y染色体主要由雄性特异区域构成,该区域不与X染色体发生重组,且携带性别决定基因及其他雄性功能基因。本期science背靠背的两篇文章,均组装了其高质量的基因组和Y染色体,通过分析祖先染色体如何演化为现有XY配对的过程,揭示了基因组的动态变化,从而检验了关于大型非重组区域进化及现有重组模式形成机制的假说。
华命生物产品服务一览

华命生物目前已开通微信公众号、抖音、知乎、B站、小红书等线上平台,欢迎感兴趣的老师扫码关注了解更多内容!