NG重磅丨中国科学家团队发表梨单倍型T2T基因组
华命生物目前已成功完成70+物种的T2T基因组组装,物种涵盖动物、植物、昆虫及同源和异源多倍体等疑难物种,已有多个合作项目在顶级期刊发表和接收,欢迎有需要的老师垂询。联系方式:18371456025。
许多重要作物具有自交不亲和性,该特性既能避免近交衰退,又能维持物种遗传多样性,进而导致基因组呈现高度杂合状态。不同亲本的杂交可产生具有多性状优势的后代。梨是全球最具经济价值的水果之一,作为自交不亲和二倍体物种,高杂合度与技术限制导致其参考基因组仍然存在间隙。
2025年8月6日,南京农业大学的吴俊教授领衔团队,在国际著名期刊《Nature Genetics》上发表了标题为“Haplotype-resolved, gap-free genome assemblies provide insights into the divergence between Asian and European pears”的重磅研究论文,首次完成了亚洲梨代表品种‘砀山酥梨’(DS)和欧洲梨代表品种‘Max Red Bartlett’(MRB)的单倍型分型T2T基因组,为梨遗传变异机制提供了新见解,并将加速梨的品种改良进程。

一、梨单倍型分型T2T基因组组装
作者采用PacBio HiFi、ONT ultra-long和Hi-C数据,通过hifiasm初步组装二倍体基因组的两个单倍型。随后利用Verkko和HiCanu的组装结果填补空缺区域及端粒区,最终每个单倍型被组装成17条染色体。其中分别有18.89和24.13 Mb区域此前未被成功组装。通过端粒重复序列鉴定显示,DS单倍型17条染色体共定位到34个端粒,MRB定位到33个。综上,作者成功完成了DS与MRB的T2T单倍型分型基因组组装。
DS与MRB单倍型包含262.86-272.23 Mb的转座元件(TEs),其中LTRs占比最高。两个品种单倍型中分别预测到42,675-43,602个蛋白质编码基因。另外在DS HapA与HapB新组装区域分别鉴定到577个和563个基因,MRB中则发现697个(HapA)和804个(HapB)。这些基因主要分布于高TE含量且单倍型间高分化区域。
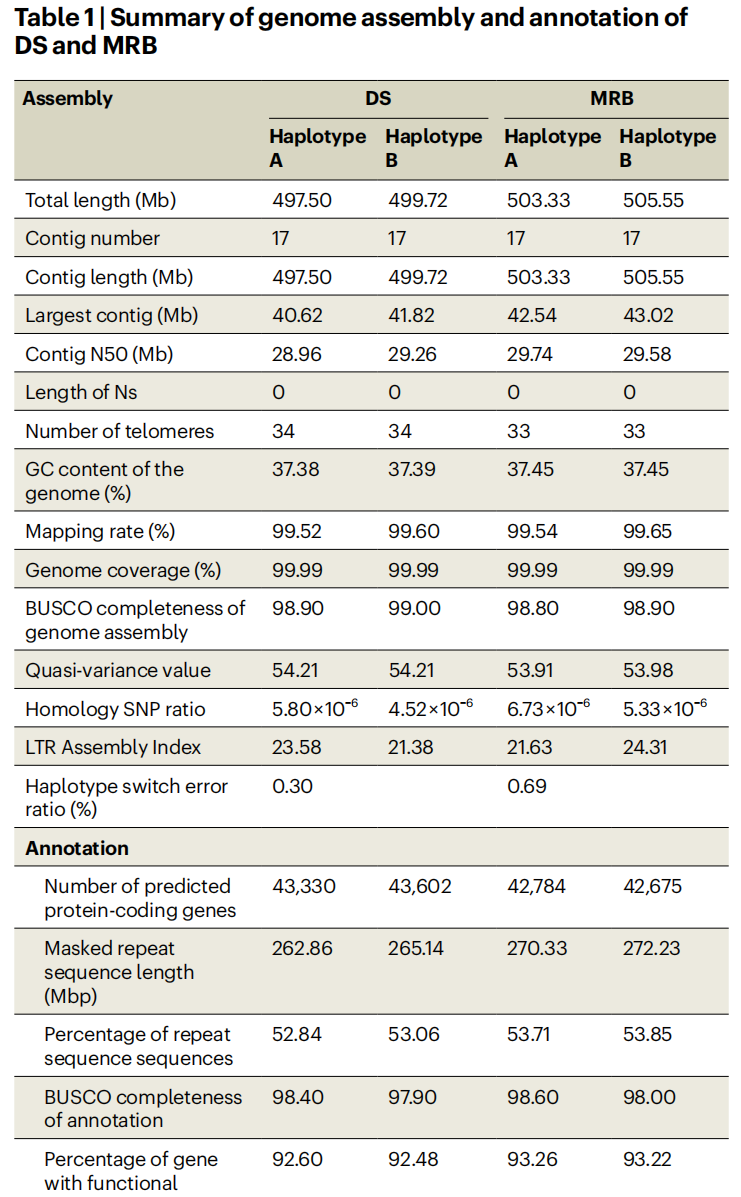
表1:DS和MRB基因组组装及注释
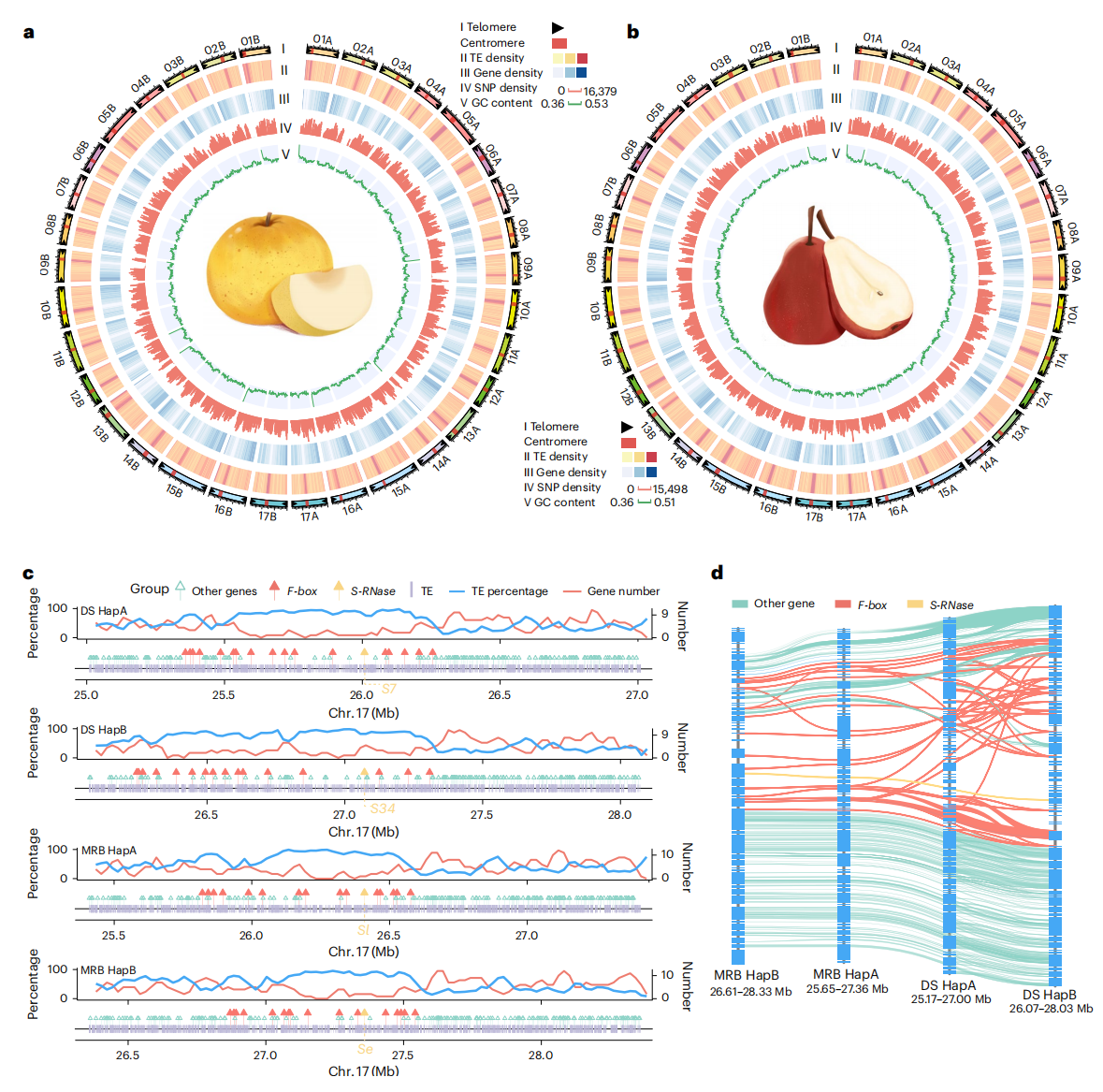
图1:DS和MRB基因组组装
二、单倍型特异性基因和ASE分析
基于直系同源基因分析,作者定义了33,710-34,036个编码序列不同的双等位基因,其中6,691-8,087个基因在对应单倍型上存在CDS相同的等位基因。此外,鉴定到1,703-1,994个单倍型特异性基因。与双等位基因相比,这些特异性基因在5 kb上下游区域及基因体内的转座元件(TE)丰度显著更高,且在DS和MRB不同果实样本中的平均表达水平更低。DNA甲基化分析显示,单倍型特异性基因在叶片和成熟果实组织中呈现更高的甲基化水平,表明这些区域可能受到更强的甲基化抑制调控。GO与KEGG富集分析表明,单倍型特异性基因显著富集于"植物-病原互作"、"环境适应"以及"生物刺激响应"等过程。
在DS和MRB八个果实发育阶段中,分别有19.64%(8,511/43,330)和26.21%(11,213/42,784)的基因至少在一个样本中表现出ASE。这些ASE基因可划分为三类:
(1)单倍型优势基因(HapDom):DS 4,498个/MRB 4,953个
(2)亚功能化/新功能化基因(Sub):DS 219个/MRB 527个(不同样本间表达优势切换)
(3)其他ASE基因(Nodiff):DS 3,794个/MRB 5,733个
另外作者发现,仅44.52%的DS-ASE基因在MRB中保持ASE模式。其中22.12%的ASE分类一致,22.40%存在分类差异。富集分析显示:不一致ASE基因主要参与生物合成与代谢通路,而一致ASE基因则集中于胁迫响应相关GO条目。
其中部分ASE基因与关键农艺性状相关,包括糖代谢相关,酸代谢相关和次生代谢相关等,其中95.26%(DS)和88.89%(MRB)的ASE基因呈现单倍型优势表达模式,表明单一等位基因对果实品质形成起主导作用。
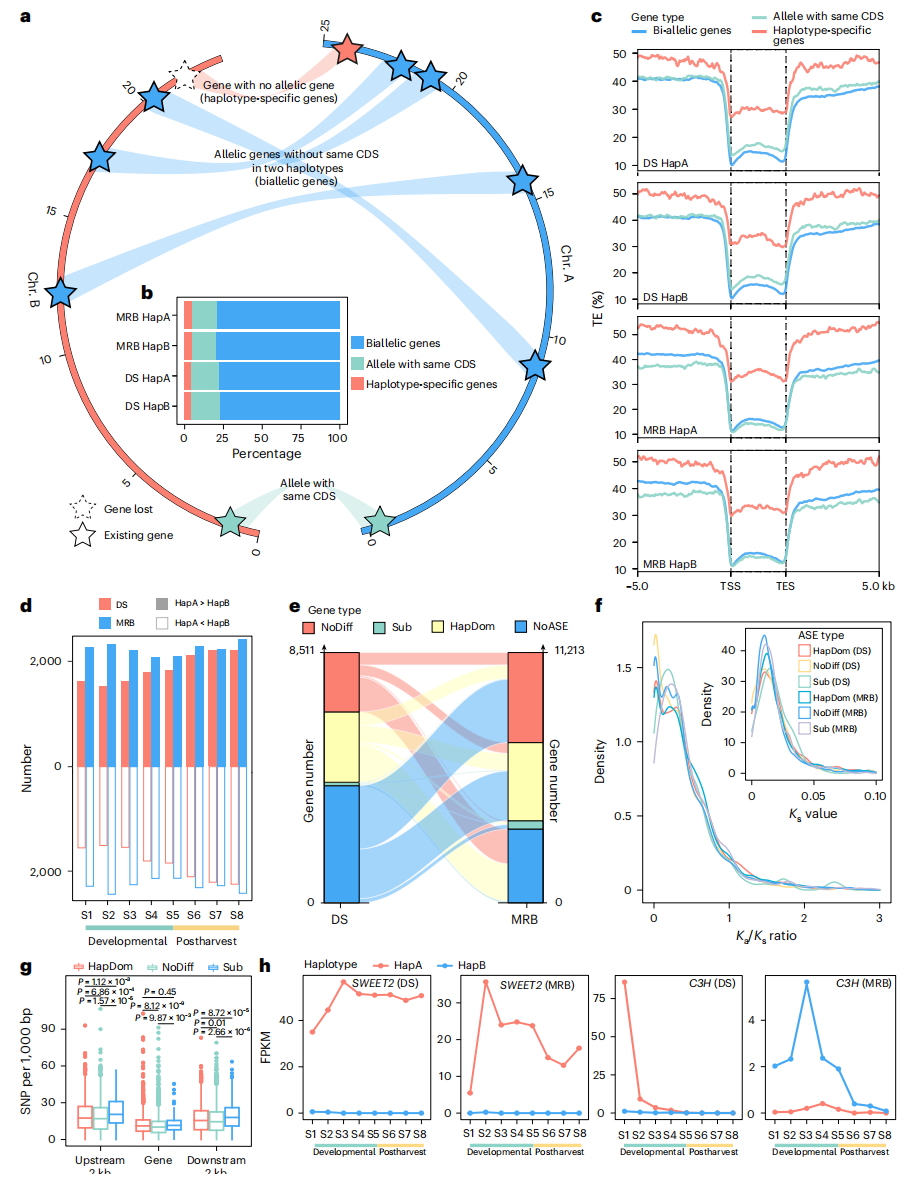
图2:DS和MRB的等位基因变异及表达模式
三、亚洲梨与欧洲梨的基因组进化分析
作者选取了DS、MRB及其他10个物种的蛋白质编码基因进行比较分析。系统发育分析表明,DS与MRB的分化时间约为360万年前。亚洲梨与欧洲梨显著的进化分歧反映在基因组变异上。基于四个单倍型构建的图形泛基因组共鉴定到103,069个SVs,其中57.42%位于基因体及其调控区(±2 kb),61.27%与TEs重叠。此外,在DS单倍型A与B的17号染色体S-位点区域存在0.58 Mb倒位,该倒位可能通过抑制重组维持自交不亲和相关基因SFB与S-RNase的连锁。
作者进一步通过对362份梨种质资源进行NGS测序数据比对,最终保留83,369个SVs。以DS单倍型A为参考时,76.82%的SVs在亚洲梨群体中出现频率>0.5,而欧洲梨群体中仅有42.73%的SVs达到该阈值。两组间存在35,481个呈现显著频率差异的SVs。
基于SNP和SV的系统发育分析将362份梨种质划分为两大分支:分支I以亚洲梨为主(含4个亚群),分支II为欧洲梨(含2个亚群)。Fst与PAC结果表明亚洲梨与欧洲梨存在长期分化历史。秋子梨的核苷酸多样性高于其野生群体,结构分析揭示了栽培梨的杂交背景,分别来源于野生秋子梨和栽培沙梨(或白梨)。Treemix分析检测到从白梨向秋子梨的基因流,表明基因渗入可能在秋子梨进化过程中起关键作用。
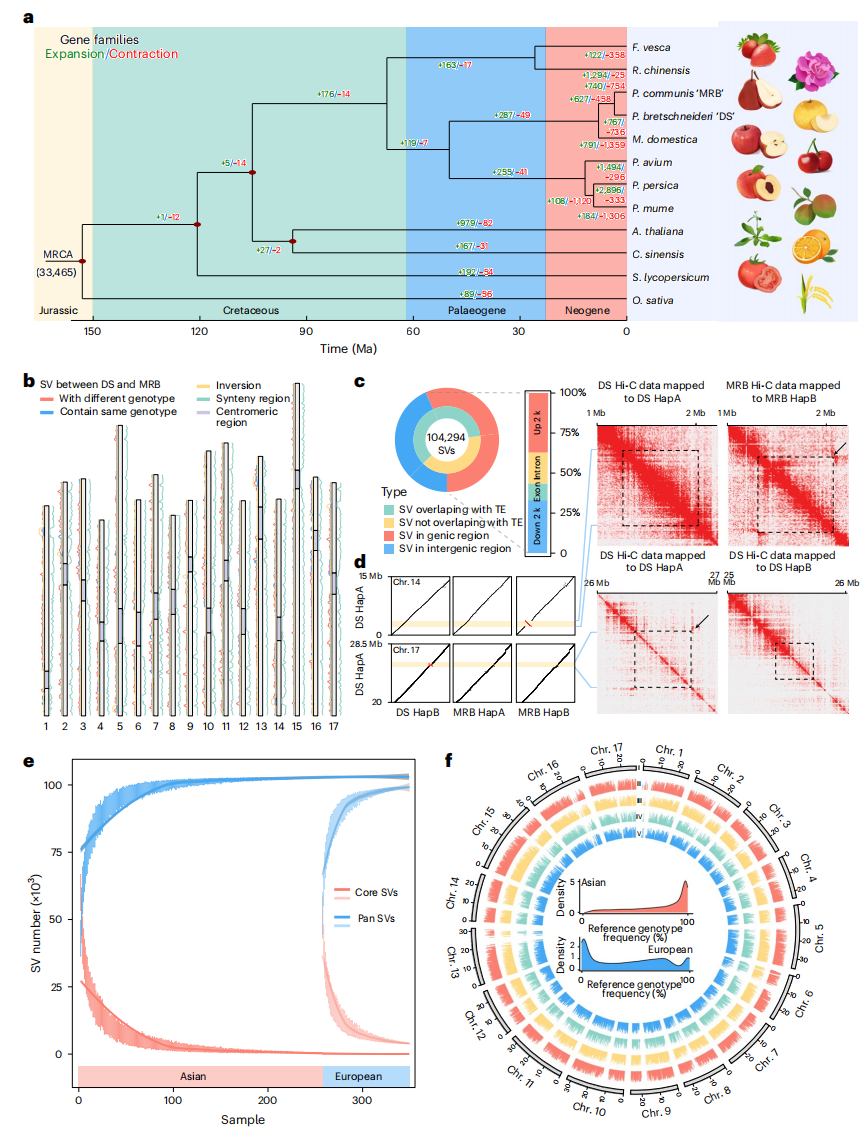
图3:DS和MRB之间的差异和SVs
四、梨果实品质的选择印记
栽培梨相较于野生祖先种,在糖酸含量、石细胞及果实大小等性状上发生显著分化。作者鉴定到亚洲梨野生种(AW)与栽培种(AC)间存在21.31 Mb的选择性扩展区域,而欧洲梨野生种(EW)与栽培种(EC)间存在14.59 Mb的选择性扩展区域,在这些区域中,共定位到123个与果实大小、发育、石细胞、酸糖代谢相关的受选择基因。其中,亚洲梨16号染色体的强选择清除区内发现酸代谢基因Ma1,大小调控基因fw2.2和糖转运基因SWEET15,Ma1和fw2.2的同源基因在栽培苹果中也经历选择,暗示苹果与梨可能通过趋同选择改良酸度和大小。另外亚洲梨驯化过程中,11个受选择的结构基因参与石细胞通路,包括转录因子PbrbZIP48和表观调控相关。
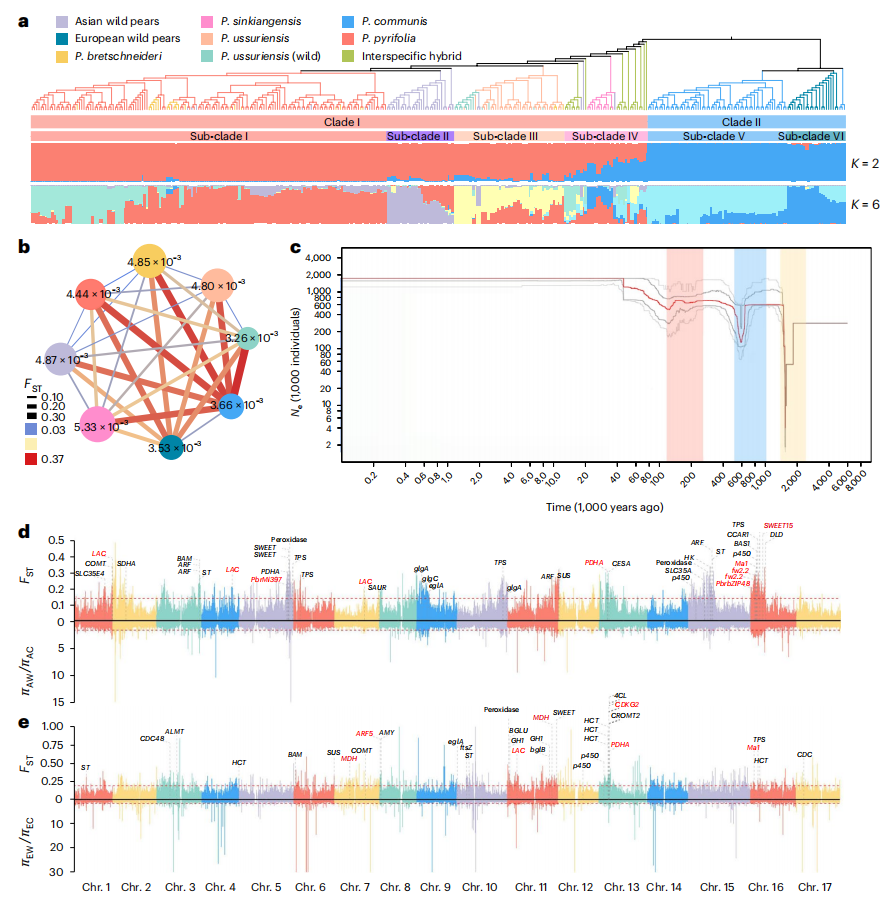
图4:不同梨群体的系统发育关系、种群历史和选择性扩展
五、农艺性状相关SVs的鉴定
SVs是作物农艺性状的重要遗传基础。作者基于83,369个高质量SVs数据集,通过SV-GWAS对梨果实横径(FTD)、可溶性固形物(SSC)、石细胞含量(SCC)及单果重(SFW)等关键品质性状进行解析。
在2号染色体上发现一个66-bp的缺失与FTD显著相关。该缺失位于亚洲栽培梨的选择性扩展区内,并且在沙梨和白梨中的出现频率显著低于亚洲野生梨。缺失型个体的平均FTD比非缺失型低11.3%。此外,缺失型的下游基因PyTPR在非缺失型中表达量显著更高。已知PyTPR基因家族在植物发育中起调控作用,这表明该基因可能通过影响细胞扩张来调控梨果实的大小。
此外作者还鉴定到一个1,016bp缺失与SSC显著相关,以及一个66bp缺失可作为果实大小选择的辅助标记。
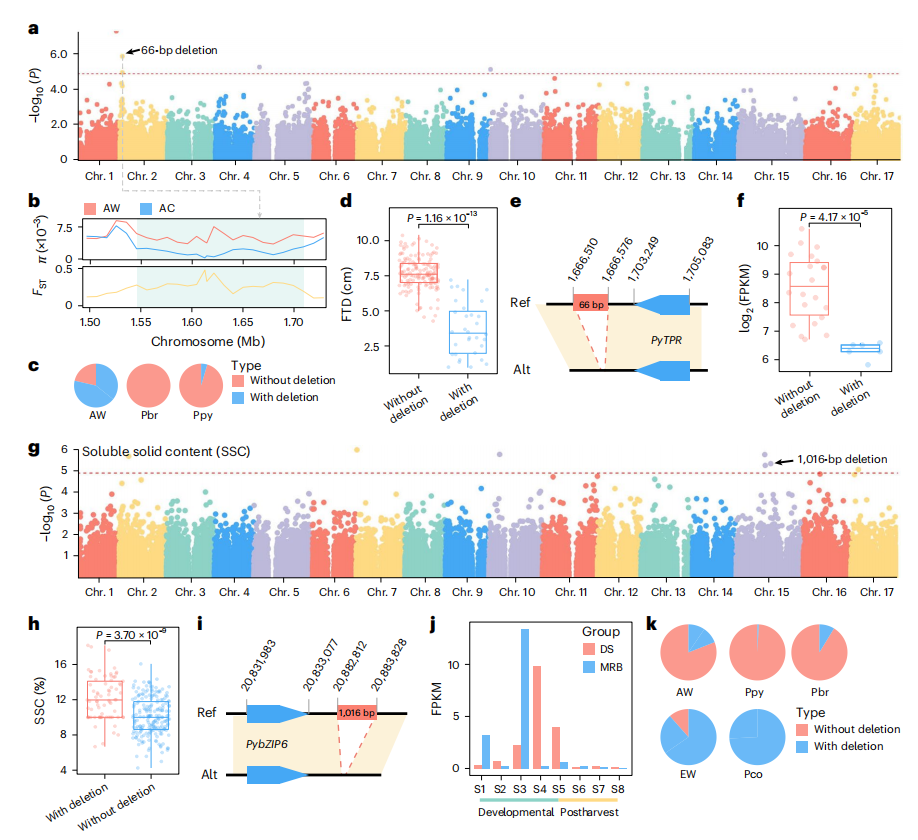
图5:FTD和SSC的SV基因组广泛关联研究(GWAS)
六、PyACS1基因在果实成熟软化中的作用机制
通过对110份梨样本的RNA-seq分析,作者发现4,040个上游2 kb区域的SVs 和 568个外显子区SVs 与基因表达显著相关。
其中70.79%的上游SVs和65.49%的外显子SVs在亚洲梨与欧洲梨间存在显著频率差异,表明SVs可能调控群体间基因表达差异。这些基因主要富集于代谢通路。此外鉴定到40个SVs与36个糖代谢相关基因显著关联,12个SVs与10个酸代谢基因相关。
相较于亚洲梨,欧洲梨的成熟软化依赖乙烯信号。作者研究发现PyACS1(Pbre1_15G535800)是乙烯合成的限速酶。在欧洲梨中PyACS1表达量显著高于亚洲梨,而且种间杂交种的表达量甚至超过双亲,呈现超显性模式。并且在MRB中,PyACS1仅在果实发育后期(S4-S5)和采后阶段(S6-S8)高表达,而DS在所有8个阶段几乎不表达。
作者进一步通过番茄过表达实验证实,OE-PyACS1株系比野生型成熟更快、乙烯释放量更高、果实硬度更低,直接证明PyACS1促进果实软化和成熟。
作者在欧洲梨和杂交种中发现PyACS1启动子区存在286bp的特异性插入。分析发现该序列含E-box和G-box,是bHLH类转录因子的潜在结合位点。共表达网络鉴定到bHLH转录因子PybHLH94与PyACS1共表达。
作者通过LUC实验验证了PybHLH94能够显著激活含286bp插入的欧洲梨PyACS1启动子,但对不含插入的亚洲梨启动子(PyACS1proDS)则未表现出激活作用。此外,作者还通过启动子截断实验和EMSA实验进一步验证了这一结果。研究表明,欧洲梨中PyACS1启动子区的286bp插入通过引入bHLH转录因子结合位点,促进了PyACS1的表达,从而增强乙烯的合成并促进果实软化。这一发现揭示了亚洲梨和欧洲梨在采后性状上的差异具有分子基础,为梨品种改良提供了重要的靶点。
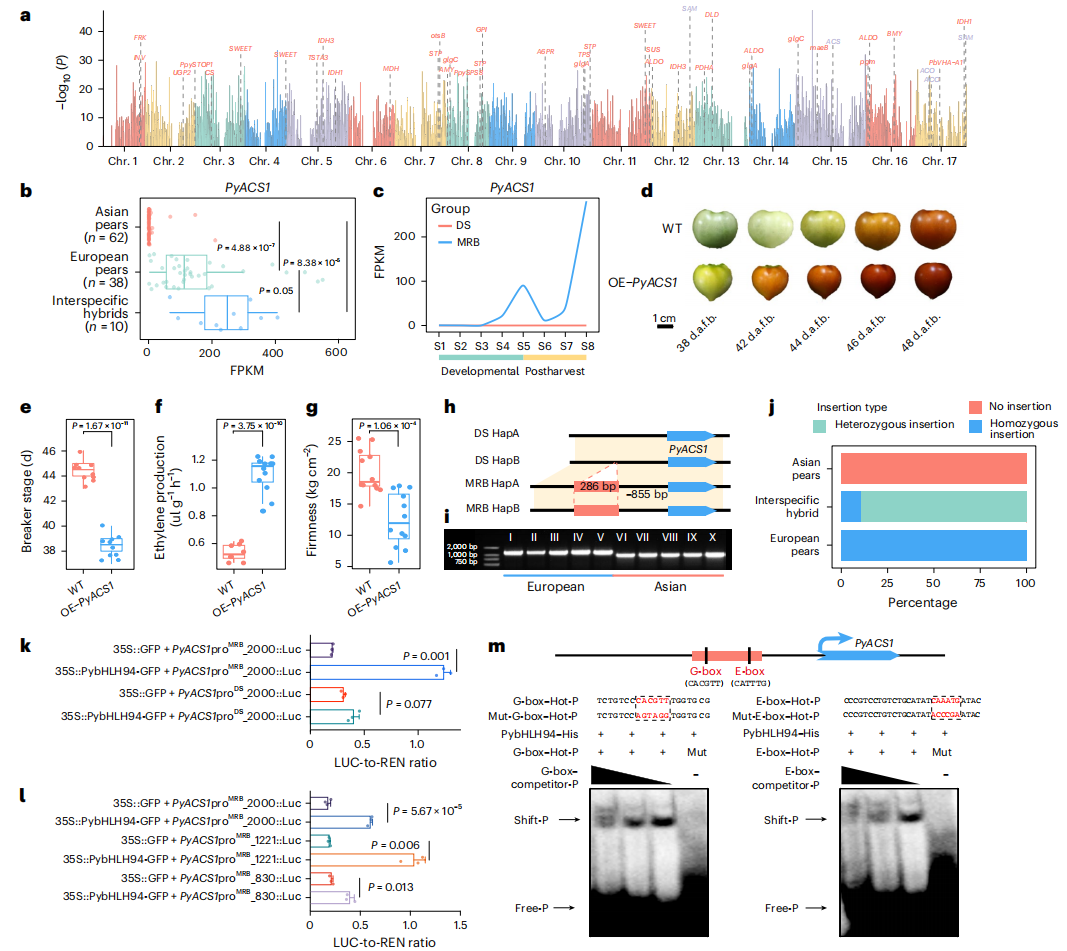
图6:与欧洲梨果实成熟和软化相关的SVs基因表达及其功能影响
结语
本研究成功构建了亚洲梨DS和欧洲梨MRB的两个T2T单倍型分型基因组,系统解析了梨属植物的基因组进化、单倍型失衡及种间变异规律。通过整合高质量基因组与群体重测序数据,揭示了亚洲梨与欧洲梨间广泛的遗传变异,并鉴定出多个性状相关的SVs。这些基因组资源不仅为后续分子生物学研究奠定基础,也将显著加速商业梨品种的育种进程。
华命生物产品服务一览
华命生物目前已开通微信公众号、抖音、知乎、B站、小红书等线上平台,欢迎感兴趣的老师扫码关注了解更多内容!