Nature重磅 | 箭虫基因组组装解码独特体型演化
箭虫(Chaetognatha)的系统发育地位长期存在争议,其体型结构自寒武纪以来保持稳定,却兼具前口动物与后口动物的特征。近年来的分子证据表明,箭虫被归类为颌口类(Gnathifera),并作为螺旋动物门的姊妹群。该结论得到了共享特殊MedPost Hox基因和化石研究的有力支持。
英国伦敦大学Ferdinand Marlétaz教授及其研究团队,于2025年7月14日在顶级期刊《Nature》上发表了一篇名为“The genomic origin of the unique chaetognath body plan”的重要论文,构建了箭虫(Paraspadella gotoi)首个高质量染色体级的基因组,并进一步系统解析了其基因组结构、细胞类型特征及进化位置,为理解箭虫独特体型的起源机制提供了理论依据。

一、颌口类中的快速基因组进化
研究生成了总计31.9 Gb的测序数据,其中包括25.9 Gb的Illumina测序数据(100×)、5 Gb的PacBio测序数据(20×)以及Hi-C数据,所有数据均用于基因组组装和三维结构分析。作者成功完成了箭虫P. gotoi的染色体水平基因组组装,获得总长约257 Mb的基因组,包含9条主要染色体。分析显示,其基因组中重复序列占比达20%,其中LTR反转录转座子(8.6%)、LINEs(4.6%)和DNA转座子(3.4%)为主要成分,共注释到22072个蛋白编码基因。
通过与其他螺旋动物的比较基因组分析发现,颌口类在进化过程中经历了显著的基因组重塑:该支系在其共同祖先节点就丢失了超过2500个祖先基因家族,特别是神经与感觉相关基因家族呈现明显收缩;而同属该支系的轮虫和箭虫又分别独立丢失了2165和1456个基因家族,形成独特的阶梯式简化模式。
特别的是,包括CenH3(CENP-A)在内的关键着丝粒组装基因几乎完全缺失。为探究这一现象的影响,作者分析了两侧对称动物祖先连锁群(BLGs)的保守性:在箭虫中仍可识别多数BLGs的框架,但已发生多次融合-混合事件;而轮虫的BLGs则完全打乱,表明其染色体进化速率更为迅猛。
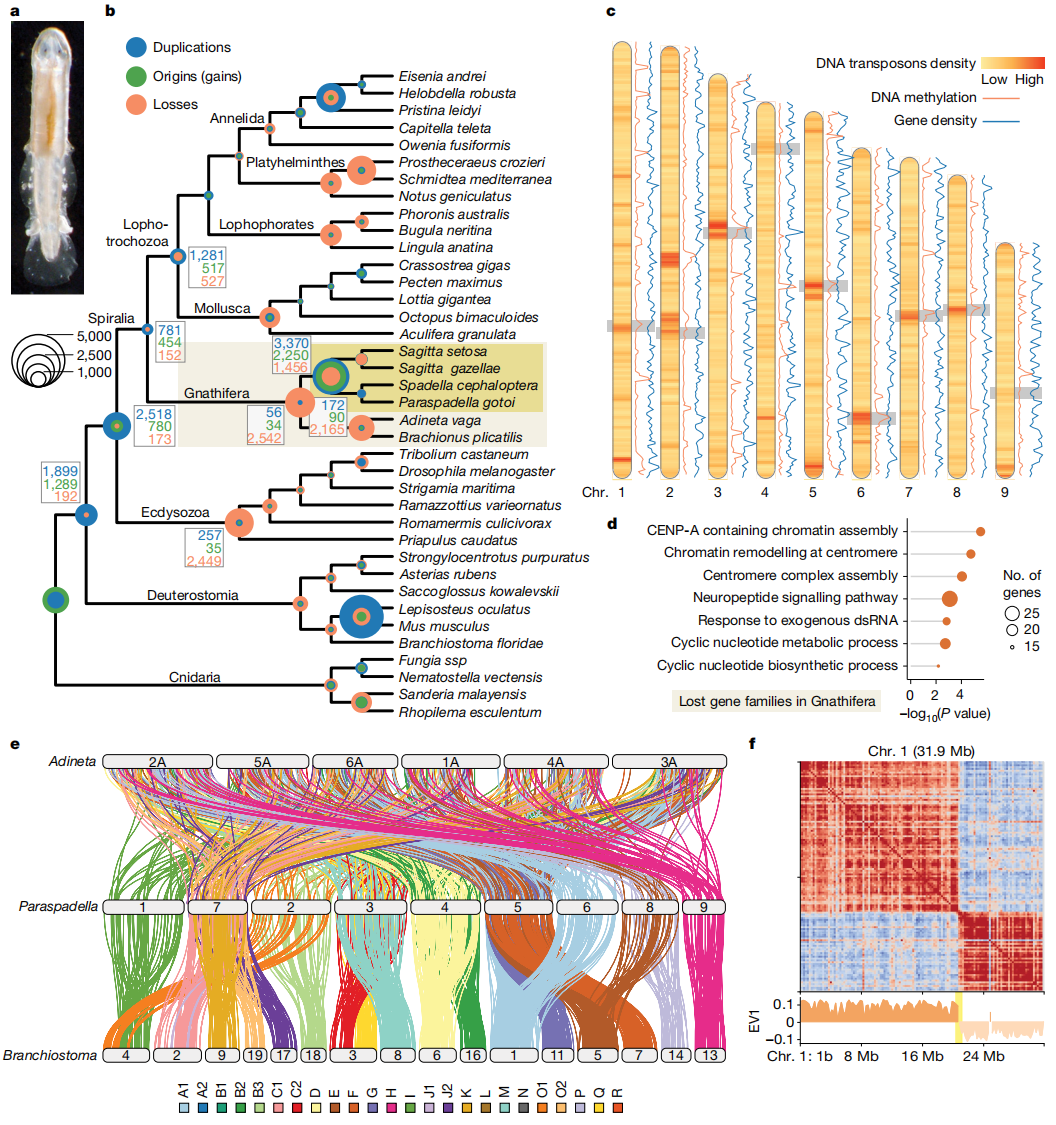
图1:颌口类与箭虫的基因组成及基因组结构的演化
二、保守性细胞类型与演化新生的细胞类型
为探究基因组变异如何塑造箭虫的独特形态,作者构建了箭虫P.gotoi的单细胞转录组图谱,鉴定出约30种细胞类型。研究发现,许多细胞类型与两侧对称动物祖先的细胞类型高度相似,包括神经元、肌肉细胞、肠道上皮细胞等,这些同源关系通过基因表达模式得到验证。在神经系统中,作者发现了多个功能特异的神经元亚群,它们富集神经递质合成、离子通道等基因,并与环节动物、软体动物等类群的神经元表现出保守性。此外,研究还鉴定了光感受器细胞和特化肌肉亚型,进一步支持了两侧对称动物祖先已具备复杂细胞多样性的观点。
除了保守的细胞类型,作者还发现了一系列箭虫特有的细胞类型,如与捕食相关的体表感觉乳突细胞、参与运动的纤毛感觉器官细胞,以及调控抓握刺发育的特化细胞。这些细胞高表达几丁质代谢相关基因,表明它们在维持箭虫多层表皮和刚性结构中起关键作用。
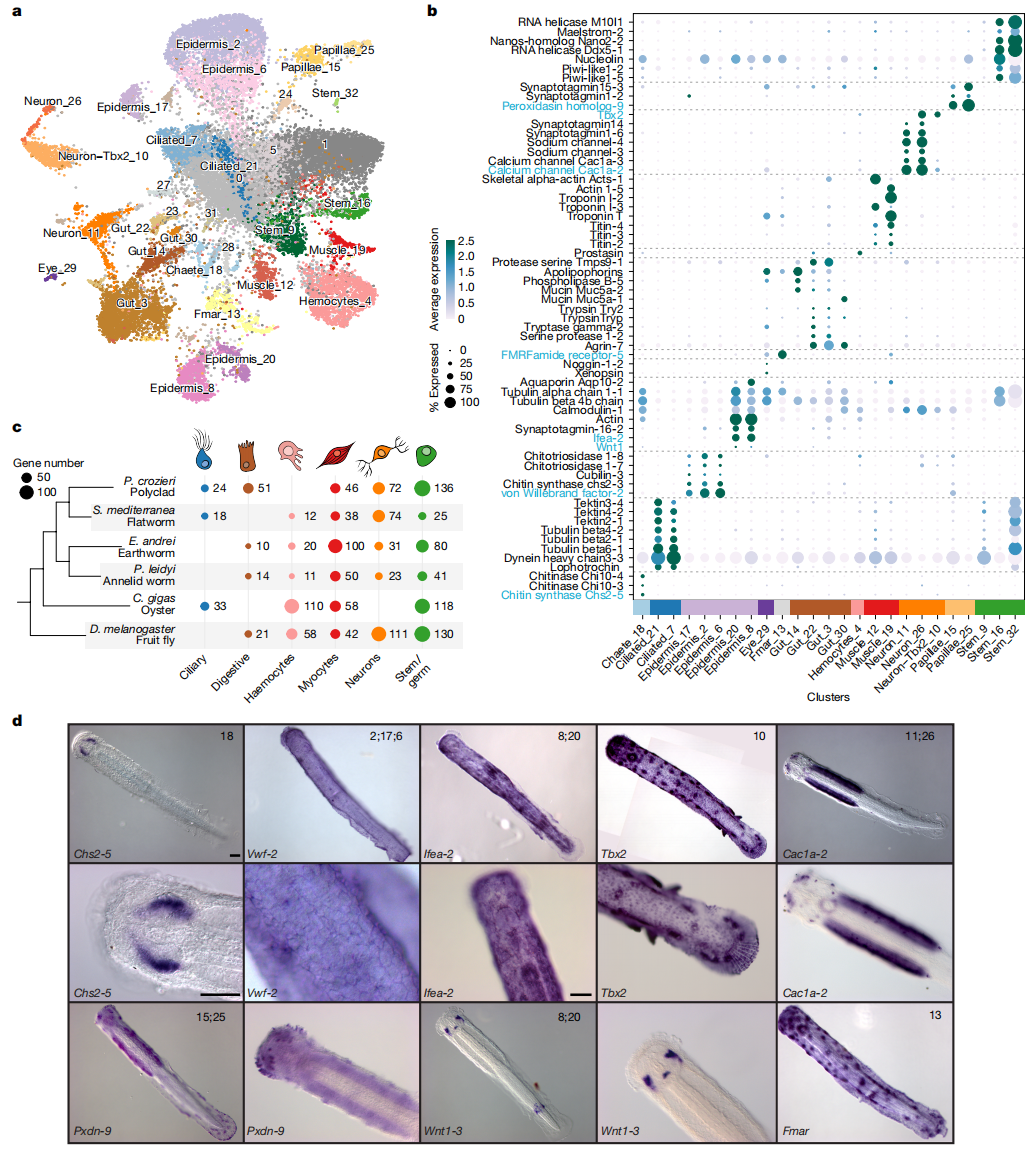
图2:箭虫的单细胞图谱
三、基因更替与细胞类型创新
研究表明,箭虫基因组经历了一次大规模的基因复制事件,可能是通过大规模串联重复而非全基因组复制。这一过程显著扩展了与离子转运和神经发育相关的基因,例如机械敏感性离子通道基因piezo和神经相关基因Elav的拷贝数分别增加到八个,而在其他无脊椎动物中通常仅为单拷贝。此外,作者还发现箭虫Hox基因簇中的Hox4-Hox8和Hox9及以后的基因显著扩增,这些发育基因的增加可能赋予了箭虫更为精细的形态发育调控能力,进而影响体节的形成和体区分化。
作者进一步指出,箭虫拥有2250个特有基因家族,占基因组的约8.3%,这一数字远超软体动物和棘皮动物。尽管这些基因大多数缺乏外部同源性,但它们在单细胞转录组中表现出受调控的表达,并作为纤毛细胞和表皮细胞的标记基因,表明它们对维持箭虫特有结构和功能至关重要。系统发育分析表明,这些基因为较为近期的创新,且在纤毛细胞中特别突出。箭虫的基因创新特征为新生基因与串联重复并存,理论上支持了细胞类型的多样性和独特体型的形成。
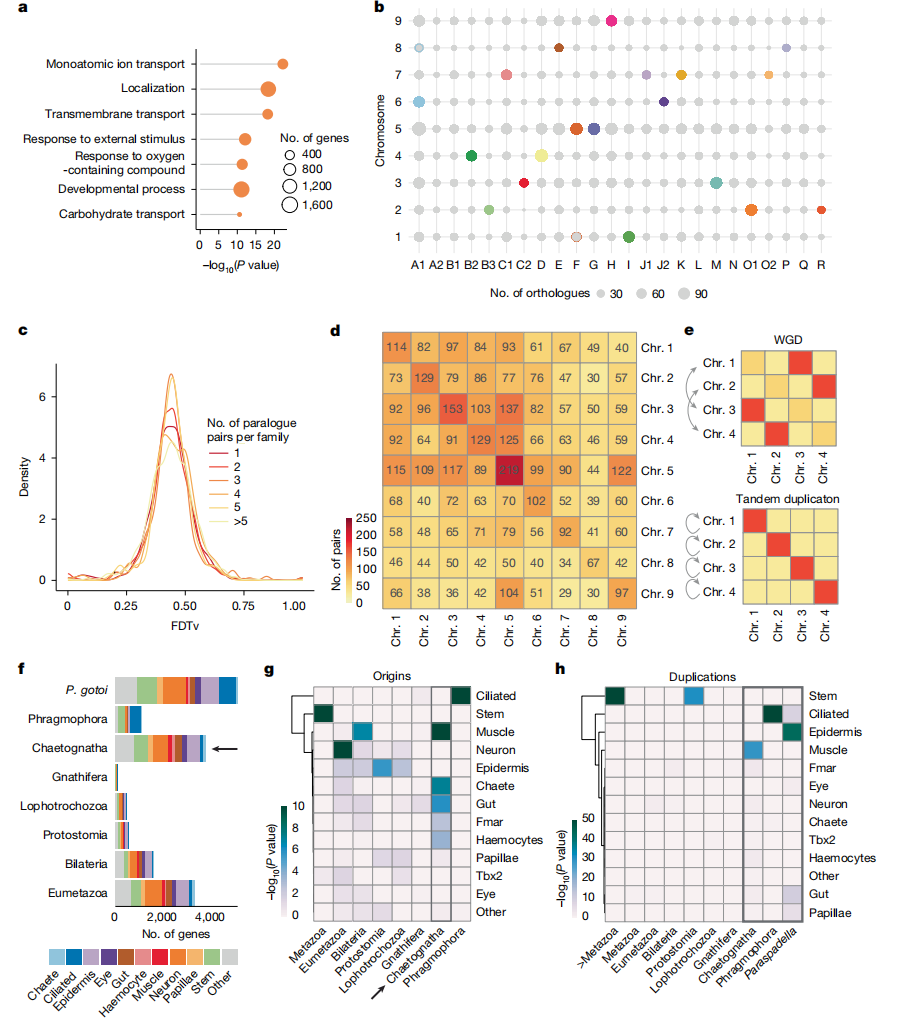
图3:箭虫中的基因复制与基因创新性
四、箭虫 Hox 基因簇的扩张
研究结果显示,箭虫的Hox基因簇发生了显著扩展,共包含14个Hox基因,总长度达2.4Mb,虽然保持了典型的共线性排列,但其间夹杂15个非Hox基因,表现出异常庞大的结构特征。进一步分析表明,MedPost稳定位于中部与后部Hox基因之间,被认为是毛鄂动物的共有特征。通过原位杂交实验,作者发现前部Hox基因在神经系统中呈广泛表达,而中部与后部基因则表现出与同源群一致的阶梯式区域化表达模式。其中,PostN4在腹神经节末端及肛后区域均有双重表达。值得关注的是,MedPost在箭虫幼体中意外地出现在表皮的乳突外周感觉神经元中,这与轮虫仅在肛后神经系统中的限制性表达形成鲜明对比。此外,箭虫仍保留后部Hox基因在肛后区的表达,而这些基因在轮虫中已经丢失。
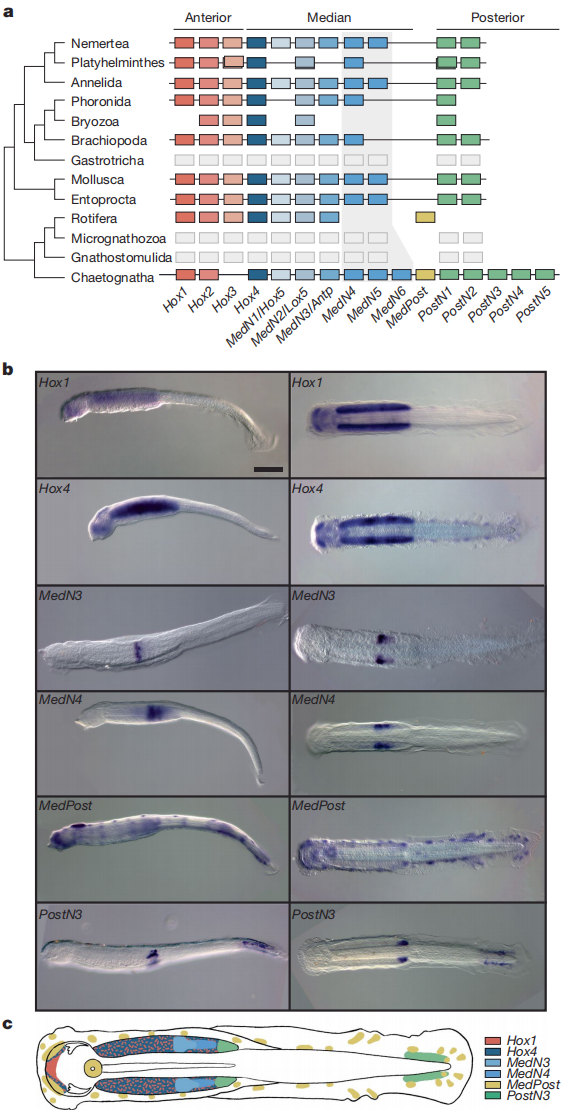
图4:箭虫中的Hox基因及其表达
五、DNA甲基化的重新靶向
作者通过进一步研究发现,大多数箭虫的基因没有经历DNA甲基化,少数被甲基化的基因含有转座子相关的蛋白结构域,表明这些基因可能是转座子的沉默基因。与其他无脊椎动物不同,箭虫在转座子上显示了明显的DNA甲基化作用,尤其是LTR转座子,而对低复杂性重复序列没有甲基化作用。这种DNA甲基化的重定向模式类似于某些真菌和早期分化的无脊椎动物。
作者还发现,箭虫的DNA甲基化工具包发生了变化,具体表现为DNMT1、UHRF1和DNMT3基因的复制和某些功能丧失,而这些基因的丧失进一步改变了其DNA甲基化过程。总体来看,箭虫的DNA甲基化特征展示了转座子甲基化和基因体甲基化的独特演化路径,为理解这种生物的基因组调控提供了新的视角。
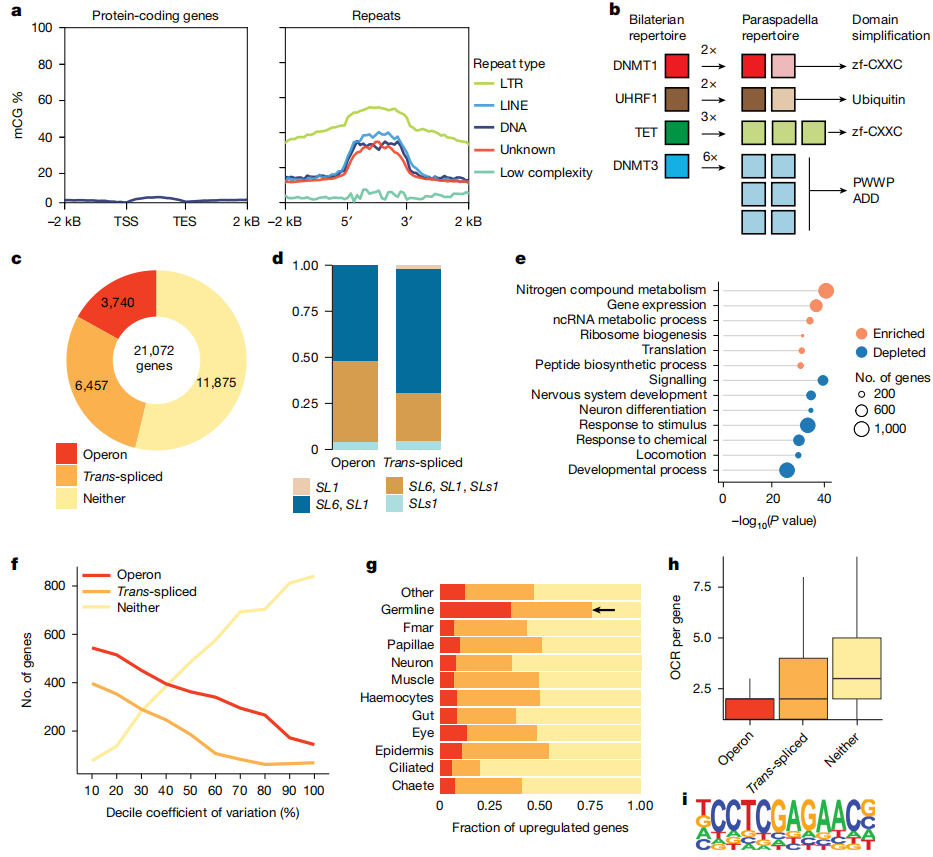
图5:基因调控,DNA甲基化和反式剪接
六、反式剪接和操作子
箭虫基因组研究表明,转录拼接在大约一半的基因中存在,并且18%的基因与操控子相关。转录拼接过程涉及在mRNA上添加剪接领导序列,而这些剪接序列通常来自位于核糖体DNA簇中的基因。作者在箭虫中进一步识别出三种不同的剪接领导序列,其中SLS1与Spadella cephaloptera共享。
转录拼接和操控转录在不同动物中分布不均,表明它们可能在不同物种中独立进化。尽管转录拼接可能在生长暂停或生殖细胞维护中起到作用,但在某些转录拼接模式中并未发现特定的操控剪接序列。从功能上看,操控基因通常与氮代谢和蛋白质代谢相关,且不涉及发育、神经系统或信号转导,这表明这些基因受细致调控,并未参与转录拼接。与操控转录拼接基因相似,非操控转录拼接基因也共享某些功能特性,而这些特性并不见于非转录拼接基因。研究还发现,与转录拼接基因相关的特定序列,且这些序列并不对应其他物种中已知的转录因子,进一步支持了转录拼接和操控转录在后生动物中独立起源的观点。
结语
本文通过高质量的基因组和单细胞图谱,深入揭示了箭虫的独特进化模式。通过比较基因组学分析发现其基因组经历了显著的重排与简化,但在此基础上又通过新基因和重复基因的扩张重新塑造了基因结构。细胞层面,箭虫既保留了双侧动物的保守类型,又发展出了特有的抓握刺、感觉乳突等特殊细胞类型。此外,研究还发现箭虫在表观遗传与转录调控上发生了重要变化,如DNA甲基化模式的迁移以及操纵子结构的普遍存在。总体而言,箭虫通过在简化与创新之间的交替过程,重新构建了其独特的感觉与运动系统,最终形成了一个稳定且独特的体型。
华命生物产品服务一览
华命生物目前已开通微信公众号、抖音、知乎、B站、小红书等线上平台,欢迎感兴趣的老师扫码关注了解更多内容!