NG重磅丨飞蝗超大基因组与染色质动态调控图谱发表
飞蝗(Locusta migratoria)具有6.9 Gb的巨大基因组,是大基因组昆虫的典型代表,以其显著的密度依赖型表型可塑性和X0性别决定系统而著称。表型可塑性是指相同基因型的生物体响应环境变化而改变表型的能力,具有明显的表观遗传特征。作为蝗虫独特的生物学特性,表型可塑性使其能够根据种群密度变化在散居型与群居型之间快速转换行为。行为转变导致蝗虫聚集,最终形成破坏性蝗灾。
2025年9月1日,中科院动物研究所康乐院士团队,在国际著名期刊《Nature Genetics》上,发表了“Chromatin dynamics of a large-sized genome provides insights into polyphenism and X0 dosage compensation of locusts”的最新论文,本研究完成了飞蝗染色体级别基因组组装及染色质结构全景注释。通过比较染色质差异探究顺式调控元件在蝗虫行为转变中的作用。同时完成了沙漠蝗染色体级别基因组组装,阐明组蛋白修饰在蝗虫X连锁基因易位中的调控机制。
一、飞蝗染色体级别基因组组装
作者结合长读长测序、光学图谱和染色质三维Hi-C测序,完成了一只雌性蝗虫成虫的基因组denovo测序(LMv3.1)。通过Hoechst染色鉴定,雌蝗第三长的scaffold被确认为X染色体,其测序覆盖度与常染色体相当,且约为雄蝗的两倍。LMv3.1组装版本的高连续性显著提升了TE的注释完整性。着丝粒周边卫星DNA的FISH显示染色体末端存在特异性荧光信号,证实了染色体末端区域的结构完整性。基于RNA表达与同源数据共预测18,127个蛋白编码基因。与LMv2.4版本相比,LMv3.1组装的全长转录本映射率显著提升,表明其更好地覆盖了RNA转录结构。基因组连续性的改善为后续表观基因组研究奠定了基础。

图1:飞蝗染色体水平基因组组装
二、超大基因中内含子增强子数量的增加
作者检测了13种组蛋白修饰,结合ATAC-seq、TSS-seq及RNA-seq,系统解析了染色质结构。组蛋白修饰丰度与基因表达水平显著相关。约40%基因组区域被划分为11种ChromHMM定义的染色质状态,对应不同调控元件。染色质状态可有效推断基因表达水平。基因间区因其基因组占比优势,构成染色质状态的最大组成部分。开放与抑制染色质状态均含有相当比例的TE,表明TE参与宿主调控创新并受表观遗传调控。
飞蝗内含子长度远超其他昆虫。染色质状态E5(增强子)和E7(双价增强子)在大内含子中的分布区域更广,表明大内含子含有更多增强子。与果蝇和蜜蜂相比,飞蝗内含子长度变化与增强子数量呈正相关,提示内含子扩张伴随增强子数量增加。基因长度变化对飞蝗基因表达影响不显著,且大小基因的表达值分布均匀,表明基因结构扩张未显著影响表达水平。含内含子增强子的大基因表达量显著高于无增强子的大基因,但这些增强子究竟提升转录水平还是增加表达调控精度尚待明确。与短基因相比,大基因显示H3K4me2、H3K4me3和H3K9ac的显著缺失,以及H3K27me2和H3K27me3的富集。综上,大基因中增强子数量的增加与基因组扩张协同作用,可能确保蝗虫中不同长度基因的均衡表达。

图2:大尺寸基因与短尺寸基因的增强子数量差异
三、行为可塑性中内含子增强子的调控机制
鉴于表型可塑性明显受表观遗传调控,作者以蝗虫行为转变为例探究大基因组的表观调控机制。PCA分析显示,群居型与散居型蝗虫脑中与调控、抑制及转录标记相关的组蛋白修饰呈现显著空间分布差异。在群居型蝗虫脑中共鉴定出1,069个上调基因和485个下调基因,功能富集分析表明这些差异表达基因涉及行为调控、信号转导、突触可塑性和免疫调节等机制。TSS区域H3K4me3与H3K27ac呈最显著正相关,凸显其在启动子调控中的作用。而TSS上游10 kb区域的H3K4me1与H3K27me3呈最显著负相关,暗示其参与远端增强子调控。与其他基因组区域相比,TSS上游10 kb区域的H3K4me1与H3K27ac重叠度最低,表明该区域存在缺乏转录激活功能的"预备增强子"。作者在差异H3K4me3/H3K27ac(启动子区)和差异H3K4me1/H3K27me3(TSS上游10 kb)区域识别出转录调控因子结合位点,Trl、Sp1和Clamp在两型蝗虫间差异表达,提示它们可能参与调控脑中组蛋白修饰差异区域。
基于基因组增大导致内含子延长的特性,作者进一步探索内含子顺式调控元件是否参与蝗虫行为可塑性调控。以Henna基因为例,TSS-seq鉴定其脑中的主导转录起始位点为TSS1,其染色质模式与两型蝗虫的RNA-seq表达差异相关。在群居型蝗虫中,TSS1区域的ATAC、H3K4me3和H3K27ac信号上调,基因体区H3K36me沉积增加。另外在Henna第一个编码外显子上游10.3 kb内含子区发现一个增强子EH1,呈现高H3K4me1和低H3K4me3信号。3C分析证实TSS1与EH1存在紧密三维空间互作。EH1敲除的群居型蝗虫中,Henna的mRNA和蛋白表达水平显著下降,行为学实验显示其行为特征显著向散居型转变。既往表明EH1敲除通过改变Henna表达复制了该表型。综上,位于长内含子中的增强子通过与启动子互作调控蝗虫行为可塑性。

图3:蝗虫散居型与群居型转变过程中的表观调控改变
四、减数分裂沉默中X染色质的动态变化
在脑和腿肌组织中,作者发现X染色体与常染色体基因表达在两性间呈强正相关,表明体细胞中X染色体表达水平在两性间保持平衡。但与常染色体不同,X染色体在卵巢中的表达高于睾丸,说明性别间表达平衡仅在体细胞中维持,而在性腺中失衡。
睾丸中X/A表达比接近0.5,这是减数分裂性染色体失活的关键指标。X染色体显示出更高的Hi-C信号/互作频率,互作矩阵中主对角线外侧出现平行线,这种增强的互作频率为X染色体特有。互作频率随距离衰减的对数曲线显示,X染色体在10-60 Mb长距离范围内衰减更慢,表明其长程互作频率相对较高。因此,失活X染色体在高级染色质结构中更紧缩,这与活性染色质区域倾向于互作的观察一致。
通过量化染色体内(顺式)和染色体间(反式)互作,评估X染色体与常染色体的空间距离。正如预期,顺式互作多于反式互作,且X染色体的反式互作频率尤其低,表明X染色体在染色体疆域中处于更边缘的空间位置。X连锁单拷贝基因Pex5的DNA-FISH实验显示X染色体比常染色体更紧缩,说明失活X染色体远离核斑转录中心。
睾丸中X连锁基因H4K16ac信号的全局降低与两性表达平衡丧失一致,表明雄蝗X染色体存在染色质抑制。早期生殖细胞显示H4K16ac富集,而进行减数分裂的精母细胞则呈现H4K16ac缺失,这与睾丸中X连锁基因H4K16ac信号全局降低相符。染色质区室分类显示H4K16ac分布与转录活性强烈相关。X染色体A区室的高表达基因密度低于常染色体。这些结果表明睾丸中X染色体表达平衡的丧失可能与染色体间空间距离、区室化结构及H4K16ac缺失相关。因此,巨大的X染色体凭借其独特的染色质结构和相对远离的空间位置,在减数分裂沉默中形成了与常染色体隔离的染色体疆域。

图4:减数分裂沉默中X染色体的全局互作与染色质重塑
五、体细胞中X染色体的剂量补偿机制
在脑和肌肉组织中,雌雄蝗虫的X连锁基因表达量与常染色体相当,表明雄蝗存在完全剂量补偿。雌性个体杂合性转录组分析显示,X连锁基因在雌蝗体细胞中呈双等位基因共表达。
通过分析H4K20me1、H4K16ac、H3K27me3和H3K9me3的基因组分布,作者探究这些修饰是否参与蝗虫剂量补偿。H4K16ac在基因区的富集程度高于其他三种修饰。常染色体上四种修饰的雌雄信号均衡。但在X染色体基因区,仅H4K16ac的雌雄富集比密度集中于1,符合其介导完全剂量补偿的作用。雌性中常染色体与X连锁基因的组蛋白修饰水平相似。与H4K16ac遍布基因体不同,H4K20me1主要位于基因5'端,但其在雄蝗X连锁基因中的水平低于理论估值。尽管H4K20me1与MSL复合物密切关联,但蝗虫两性间SXL和MSL亚基的RNA/蛋白表达无显著差异,表明蝗虫剂量补偿的启动不依赖SXL。综上,H4K20me1的缺失与H4K16ac的富集功能关联,共同维持雄蝗体细胞中X染色体的表达平衡。
与其他修饰不同,X染色体基因间区的H4K16ac水平随与最近基因距离的增加而降低,表明其剂量效应具有距离依赖性,仅实现部分剂量补偿。与果蝇不同,未检测到H4K16ac信号覆盖雄蝗整个X基因组。因此,H4K16ac的剂量效应始于基因区,在向基因间区扩散过程中逐渐衰减,这种距离依赖性限制了大基因组中剂量补偿效应的扩展。

图5:体细胞中X染色体的平衡表达机制
六、易位X连锁基因的剂量补偿机制
通过目级水平昆虫X连锁基因保守性分析,发现蝗虫X染色体基因源于大规模基因组重排导致的染色体间基因交换。为探究直翅目内飞蝗X连锁基因的形成机制,我们完成了沙漠蝗(Schistocerca gregaria)染色体级别基因组组装,并对比分析了飞蝗、沙漠蝗、小菱蝗(Zhengitettix transpicula)和蚤蝼(Xya riparia)的染色体对应关系。飞蝗与沙漠蝗染色体完全对应,但与小菱蝗和蚤蝼呈"一对多"或"一对零"对应,表明锥头蝗科早期物种分化中基因组扩张伴随大规模染色体重排。飞蝗X连锁基因自锥头蝗科起源后主要保留在X染色体上,但尚不能确定蚤蝼X染色体代表祖先X染色体还是常染色体与性染色体融合产物。
将四物种一对一同源基因分为五类:古常染色体基因、古X连锁基因、古常转X基因、古X转常基因和新常转X基因。与新常转X类别相比,古常转X和古X类别显示更低的H4K20me1雌雄信号比,以及更低的H4K16ac雌雄信号比,提示新近易位的X连锁基因存在剂量补偿重建滞后。
与古X类别和两个常染色体类别相比,古常转X类别具有显著更高的dN/dS值,表明适应性进化更可能作用于古常转X基因。而且古常转X类别比新常转X类别展现更广分布和更高水平的组蛋白修饰,说明X连锁易位基因可能积累序列分化或保留难以通过重组有效清除的突变,最终促进基因功能创新。新常转X类别中包含Oat和msps等先前报道对雄性有害或对雌性有益的基因,表明性拮抗选择促进雌性相关基因从常染色体易位至X染色体。这些基因可通过减数分裂性染色体失活被抑制,从而缓解雌性拮抗效应并提高雄性精子发生适合度。因此,飞蝗中易位的X连锁基因可能被趋同招募至X染色体,并因需在精子发生中抑制其雌性偏好功能而经历剂量补偿重定位。综上,新常转X类别在组蛋白修饰上呈现显著差异,表明飞蝗中新近从常染色体易位的X连锁基因存在剂量补偿重定位滞后。

图6:源自常染色体的X连锁基因的剂量补偿转换机制
结语
本研究完成了沙漠蝗和飞蝗的染色体级别基因组组装,并绘制了飞蝗的全面染色质图谱。研究发现基因组增大与内含子区域扩张导致的增强子数量增加相关,同时鉴定出一个导致散居型与群居型蝗虫行为差异的远端增强子。在X0性别系统中,H4K16ac富集和H4K20me1缺失共同维持雄性体细胞中X染色体表达的平衡,揭示了大基因组中特殊的剂量补偿机制。这种距离依赖性H4K16ac修饰进一步导致近期从常染色体易位至X染色体的基因在剂量补偿演化上出现滞后。因此,扩张的内含子区与基因间区共同塑造了大基因组中独特的染色质调控景观。
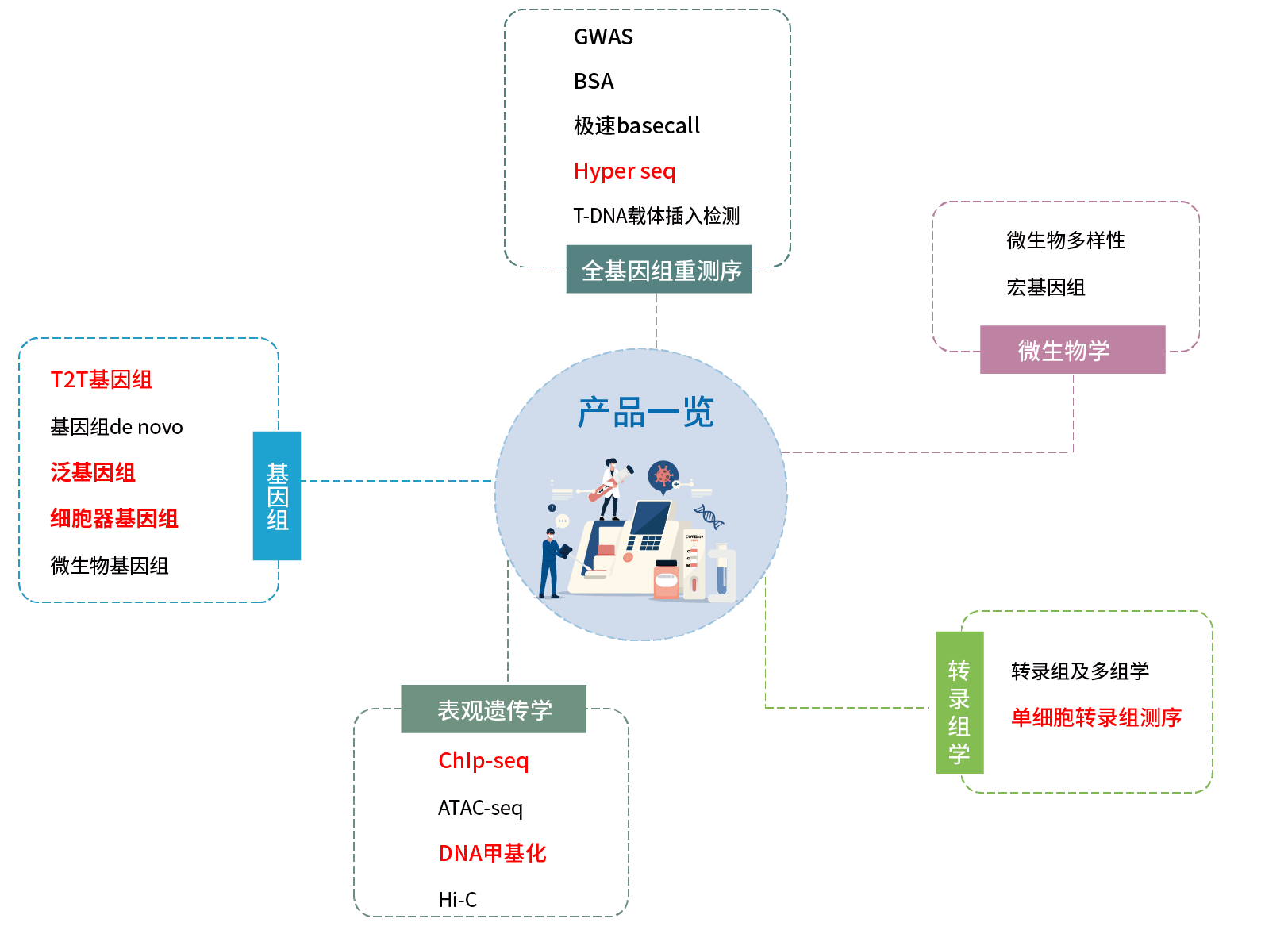
华命生物产品服务一览
华命生物目前已开通微信公众号、抖音、知乎、B站、小红书等线上平台,欢迎感兴趣的老师扫码关注了解更多内容!